483 数据库是一个用于查找和获取制药公司被美国食品药品监督管理局(FDA)发布的483表格的工具。FDA 483表格(FDA Form 483)是指 FDA 对制药公司进行质量系统审核后发现的违规行为和不符合要求的问题所写的一份文件。这些问题可能涉及生产、质量控制、记录保存、设备维护等方面。
483与警告信的区别是:
FDA 483表格是在检查后的不良情况汇总,如果没有及时回复(15日内)才有可能被发警告信,在FDA官网上,可以看到FDA表格483用于向公司管理层通知不良情况。检查结束时,将提交FDA 483表格并与公司高级管理层讨论。鼓励公司以书面形式回应FDA 483表及其纠正措施计划,然后迅速实施该纠正措施计划。
FDA警告信(Warning Letter)则是非常严重的,当FDA发现制造商严重违反FDA规定时,FDA会通知制造商。此通知通常采用警告信的形式。警告信指出了违规行为,例如不良的制造规范、产品功能声明的问题或不正确的使用说明。这封信还明确表示,公司必须纠正问题,并为公司向FDA通报其纠正计划提供了指示和时间表。FDA然后检查以确保公司的更正是充分的。FDA警告信中描述的事项可能会受到FDA与信件收件人之间后续互动的影响,这可能会改变信中讨论的问题的监管状态。
如果FDA认为企业对483的回复不充分,FDA会开警报信。二者还有一个区别是,警告信是公开在FDA官网的,所有人都可以看到。
收到了警报,对于制造商,至少就不能美国市场继续销售产品了。而且这封信是全球都可以看到的,公司的名誉瞬间下滑,还有好多国家卫生部门会在看到警报信后,也将这家公司的产品列入禁止进口名单。
483检查后,与之相关对应三种状态分别的含义如下:
NAI(No Action Indicated)等同于零缺陷。
VAI(Voluntary Action Indicated)可以视为被发了Form 483,如果回复不及时或不被接受则会导致被发警告信。
OAI(Official Action Indicated)会被发警告信(Warning Letter),如果警告信的回复不被接受,将会发布进口警示(Import alart),拒绝入境。
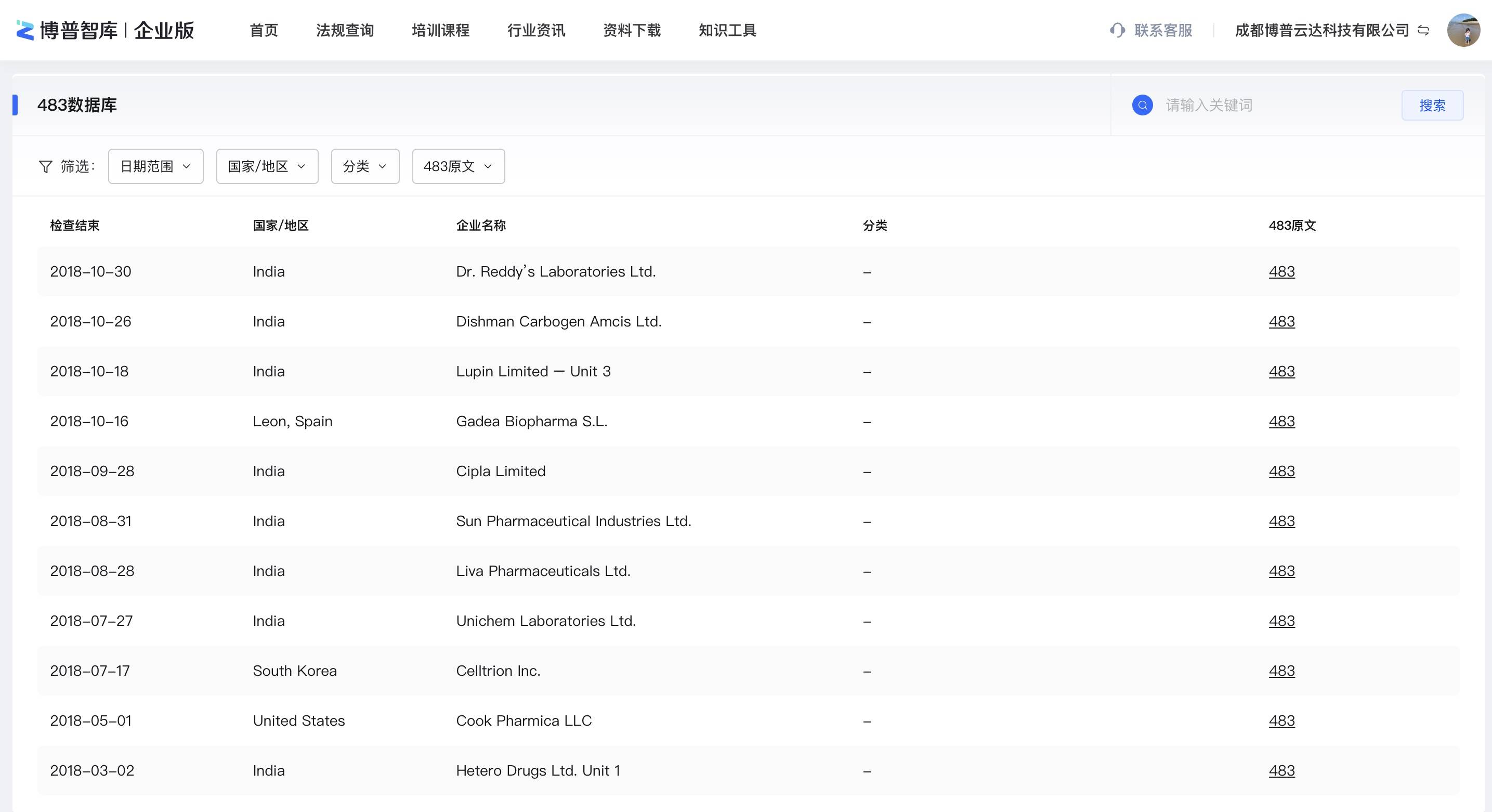
博普智库企业版483数据库为制药从业人员提供了一个便捷的途径来查询和了解其他公司在质量审核中存在的问题。这些问题可能包括生产过程中的违规行为、质量控制系统的缺陷以及无法满足法规要求的记录保存。使用 483 数据库,可以根据公司地区、分类、发出日期等关键词进行搜索,以获取相关的警告信信息。该数据库通常提供详细的描述,包括问题的性质、违规程度以及需要采取的纠正措施。
通过查询此数据库,您可以了解其他公司在质量审核中的不足之处,并从中吸取经验教训,以改进和加强自己公司的质量管理体系,确保生产的药品符合法规要求和良好的质量标准。需要注意的是,本数据库仅提供了 FDA 发布的警告信信息,并不代表其中某公司的整体质量水平。因此,在使用这个数据库时,您应该综合考虑各种因素,并采取适当的措施来确保自己公司的质量管理和合规性水平。
您可以通过「导航栏」-「知识工具」-「合规迎检工具」-「483 数据库」进行操作使用: